在过去一个世纪,由于早期下床活动成为常规,产后VTE的发生率显著下降。虽然在预防和治疗方面取得进展,但血栓栓塞仍然是导致母体死亡与发病的重要原因。肺栓(PE)大约占妊娠相关死亡的10%(美国2011-2015)。
妊娠期VTE绝对发生率很低,约1-2/1000。然而风险却为非孕期的5倍。产前产后发病例数相似。但深静脉血栓(DVT)更常见于产前,PE常见于产后。产后6周内,估计的血栓栓塞发生率约为22/10万。在第二个产后6周,发生率下降至3/10万。2%存在血栓后综合征。
血液瘀滞、局部血管壁损伤以及高凝状态是静脉栓塞的诱发因素。妊娠期这些因素造成的风险均升高。增大的子宫压迫盆腔静脉和下腔静脉更容易使下肢静脉系统瘀滞。晚孕早期到产后6周,腿部静脉流速下降50%。这是静脉血栓形成最常见诱因,静脉瘀滞、分娩、子痫前期和败血症均会对血管内皮造成损伤。另外大多数凝血因子在妊娠期显著升高有利于凝血。
妊娠期许多情况都是VTE的高危因素,其中最重要的是血栓个人史,妊娠期VTE病例约15-25%为复发事件(ACOG 2020)。另一个重要的个人危险因素是遗传性易栓症。据估计约有20-50%的妊娠期及产褥期静脉血栓形成患者具有可识别的潜在促凝遗传问题(ACOG 2020)。
据推测,在多胎妊娠、贫血、妊娠剧吐、出血、剖宫产、肥胖、子痫前期和产后感染中血栓栓塞风险升高两倍。死胎或围产期子宫切除患者血栓栓塞风险明显升高,炎症性肠病风险升高2-3倍。
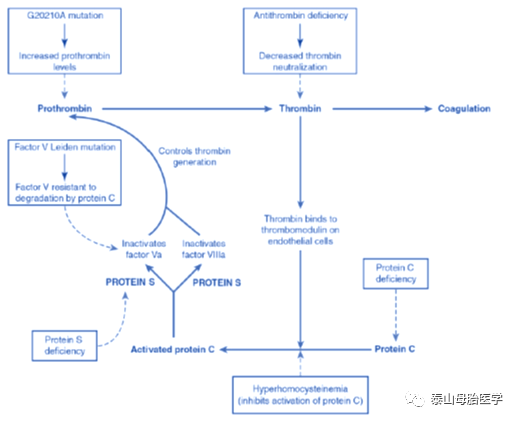
一些重要的调节蛋白作为凝血级联的抑制因子,如图所示。这些抑制因子遗传性或获得性缺陷统称为易栓症。导致高凝状态和复发性VTE。

遗传性易栓症患者通常有血栓家族史。这些因子的突变占45岁内VTE患者的一半,特别是缺乏明确危险因素患者。最大风险人群是因PE突然死亡的家族史和家族成员因为复发血栓需要长期抗凝。
抗凝血酶产生于肝脏,是凝血酶抑制及凝血酶和Xa灭活最重要因子之一。在肝素作用下,抗凝血酶活性放大1000倍。抗凝血酶缺乏可来自AD遗传数百个位点突变的I型缺乏,造成正常生物学功能的抗凝血酶合成下降,也可以来自正常水平但功能活性下降的II型缺乏。
抗凝血酶纯合缺陷是致死性的。杂合缺陷影响大约1/2500人,这是最容易形成血栓的遗传性凝血病。血栓形成风险与缺乏的程度相关。在普通人群中抗凝血酶缺乏使得VTE风险上升25-50倍,妊娠妇女中风险增加6倍。
对于抗凝血酶缺乏孕妇使用低分子肝素能明显降低血栓栓塞发生,且能降低50%的死胎及FGR风险。在需要抗凝治疗撤退时,如手术或分娩或者在抗凝治疗时发生VTE时,也可以采用重组人抗凝血酶。
当凝血酶与小血管内皮细胞血栓调节蛋白绑定时,其促凝活性被中和。同时也激活蛋白C,后者为天然抗凝物。在蛋白S协同下控制凝血酶产生,部分是通过灭活Va因子和VIIIa因子。
蛋白C活性在妊娠前半段中等程度但显著增加。有人推测,蛋白C的增加通过参与抗凝和炎性调节通路在维持早孕方面起作用。
已发现蛋白C存在超过160种不同的常显突变。杂合突变率约为2-3/1000。但大多数因为外显度高度变异而并无血栓病史。这与50-60%的功能活性阈值相符。VTE风险升高6-12倍。纯合突变可导致新生儿致死性暴发性紫癜。败血症也能导致杂合突变成人患者暴发性紫癜发生。
循环抗凝物被蛋白C激活,后者也能增强蛋白S使Va和VIIIa因子失活的能力。蛋白S缺乏症可能由130多种不同突变导致。杂合突变的总发生率约为0.3-1.3‰。蛋白S的缺乏可以通过测定游离、功能和总S水平来判断。在正常妊娠期,三种S水平均有实质性下降。因此,对孕妇的诊断以及对服用特定避孕药人群的诊断是非常困难的。如果在妊娠期间必须筛查,中、晚孕期游离蛋白S水平的阈值分别为<30%和<24%。确定蛋白S缺乏,妊娠期间发生VTE的风险会增加数倍。
如有阳性家族史,妊娠时的VTE风险为6-7%(ACOG,2020a)。
Conard等(1990)报道了29例蛋白S缺乏孕妇中有5例血栓形成;Burneo等(2002)报道了此类孕产妇出现脑静脉血栓。新生儿纯合蛋白S缺乏症通常与暴发性紫癜有关,这是一种致命性临床表型。
这是已知易栓症中最普遍的一种,其特点是血浆对激活的蛋白C抗凝效应具有抵抗力。有几种突变会产生这种抗性,但最常见的是V leiden突变。这种错义突变来自V因子第506位以谷氨酰胺代替精氨酸。由于这种突变,激活的V因子被激活蛋白C中和的速度降低约10倍。进而导致凝血酶产生速度增快。
V leiden的杂合遗传是最常见的遗传性易栓症。在一些欧洲国家中,有3%-15%的人口存在这种情况。1.2%的非裔美国人以及2.2%的西班牙裔美国人存在此类突变。但在非洲黑人和亚洲人中几乎没有(ACOG,2020a)。妊娠期间VTE病例属于V leiden杂合突变约占40%。然而,杂合突变、无个人史或一级亲属50岁前没有血栓事件的妊娠妇女实际血栓风险约为5-12‰。相比之下,这一风险至少是有个人或家族病史孕妇的10%。纯合突变、没有个人或家族史的孕妇发生VTE的风险约为1-4%,然而具有个人史或家族史的约有17%的VTE风险(ACOG,2020a)。
妊娠期间的诊断可通过对突变V因子基因DNA分析做出。由于早孕期后其他凝血蛋白浓度的改变而出现正常抗性,所以不使用生物测定法。值得注意的是,活化蛋白C抵抗也可由抗磷脂综合征导致。
为评估母体V leiden突变的预后意义,Kjellberg等(2010)比较了491名携带者与1055名对照者的结果。三例血栓栓塞均为携带者。但早产率、胎儿体重或高血压并发症发生率在两组间没有差异。在一项对近5000名妇女的前瞻性观察研究中发现杂合突变的发生率为2.7%(Dizon-Townson,2005)。出现三例肺栓塞和1例深静脉血栓,发生率为0.8‰。无一例是携带者。此外,在杂合突变妇女中,先兆子痫、胎盘早剥、胎儿生长受限或妊娠丢失等发生率均没有升高。研究结论认为产前对V leiden突变和对没有发生过VTE的携带者进行预防是不合适的。
凝血酶原基因错义突变导致过多凝血酶原积累转化为凝血酶。杂合和纯合突变会导致凝血酶原水平分别增加约30%和70%(MacCallum, 2014)。与V Leiden一样,具有个人史或一级亲属50岁以前发生VTE会增加妊娠期间发生VTE的风险。具备此类病史的杂合携带者,VTE风险超过10%;而没有此类病史的杂合突变携带者发生VTE风险不到1-2%。妊娠期间发生VTE的风险不到1%(ACOG,2020a)。
Silver等(2010年)对近4200名妇女进行了检测,以了解凝血酶G20210A突变。共有157人或3.8%的人群携带该突变,其中只有一人是纯合突变。在妊娠丢失率、先兆子痫、胎儿生长受限及胎盘早剥方面,携带者与非携带者无明显差异。其中发生血栓栓塞的三名患者该突变为阴性。
纯合突变患者或具有G20210A与V leiden双重杂合突变患者,血栓栓塞风险比杂合子携带者要高(Connors, 2017)。
同型半胱氨酸升高的最常见原因是C667T热敏型5, 10-亚甲基四氢叶酸还原酶(MTHFR)的突变。遗传模式为常染色体隐性遗传。同型半胱氨酸水平升高也可能是由于参与甲硫氨酸代谢的酶类缺乏、或因为可纠正的叶酸、VB6或VB12缺乏所导致。在正常妊娠期间,同型半胱氨酸平均血浆浓度下降,使诊断变得困难(Lockwood, 2002)。
den Heijer等(2005)对多项国际血栓研究的荟萃分析发现MTHFR多态性可能带来稍高的患病风险。但在北美研究(denHeijer,2005)中没有发现与血栓形成有关的情况。推测叶酸补充可以解释这种差异。叶酸在同型半胱氨酸的再甲基化转化为甲硫氨酸反应中充当辅助因子。同样,ACCP认为与血栓栓塞没有关联可能是因为妊娠期同型半胱氨酸水平生理性降低以及广泛的产前叶酸补充导致(Bates, 2012)。ACOG(2020a)得出结论,没有足够证据支持评估MTHFR多态性或在评估VTE时检测空腹同型半胱氨酸水平。
蛋白Z是一种依赖维生素K的蛋白,作为Xa失活的辅助因子。研究发现,低蛋白Z水平增加了非妊娠女性的血栓栓塞风险,也可能参与了不良妊娠结局的发病机制(Almawi,2013)。同样,1型纤溶酶原活化蛋白抑制物(PAI-I)是一种重要的纤溶调节因子。该基因启动子的某些多态性可能轻微增加VTE风险。即使这些易栓症因素共存会加重血栓疾病风险,但ACOG(2020a)仍认为筛查这些因素证据不充分。
获得性易栓症
获得性高凝状态的一些例子包括抗磷脂质综合征(APS)、肝素诱导的血小板减少症和癌症。
这种血栓前疾病可以同时影响静脉和动脉循环。下肢深静脉和脑部动脉分别是静脉和动脉循环血栓形成的最常见部位(Garcia, 2018; Konkle, 2018)。除了血栓形成,其他APS的主要临床表现是产科不良结局。APS的标准还包括:(1)至少一次10周或以上不明原因的胎儿死亡;(2)至少有一次孕34周前因子痫、严重子痫前期或胎盘功能不全发生的早产;或(3)至少连续三次无法解释的10周前自然流产。对APS以后详述。
对不明原因出现动脉或静脉血栓栓塞或有一次胎儿丢失病史或三次及以上复发性胚胎或胎儿丢失妇女可进行抗磷脂抗体检查(ACOG,2020a)。对未足月严重的子痫前期和早发的胎盘功能不全不支持该检测。有证据表明HELLP综合征伴抗磷脂抗体阳性的孕妇预后较差。(Pécourt, 2021)。应检测的指标包括:(1) 狼疮抗凝血物、(2) 抗心磷脂抗体G和M (IgG和IgM)以及(3)抗β2糖蛋白-I IgG和IgM抗体。如果这些实验室结果中有任何一项为阳性,则需要12周后再行确认(Connors, 2017)。
根据对750例单胎合并APS的研究。Saccone等(2017)发现,抗心磷脂抗体是最常单独存在的抗磷脂抗体。APS孕妇在妊娠或产褥期有5%-12%的血栓风险。事实上,这些血栓事件中高达25%发生在妊娠期间或在产褥期。
与过去观点相反,遗传性易栓症和不良妊娠结局之间没有明确的因果关系(Ormesher,2017)。这种混乱是由一些观察性研究导致,后来又进行了大型前瞻性队列研究予以阐释。目前,ACOG(2020a)不建议对有胎儿丢失史或不良妊娠结局如胎儿生长受限、胎盘早剥和子痫前期等患者行遗传性易栓症筛查。
目前还没有令人信服的证据表明遗传性易栓症与胎儿丢失之间的关系。因此,阿司匹林或肝素治疗没有任何好处,临床实践中过分放大了抗磷脂抗体导致复发性流产的作用。死胎在杂合突变中也不是很常见。但与V leiden因子纯合突变有微弱关系(Silver,2016)。最后,目前也没有足够证据支持筛查死胎妇女中的遗传性易栓症(Arachchillage,2019)。
胎儿生长受限在遗传性易栓症中也不是很常见(ACOG,2020a; Infante-Rivard, 2002)。同样,也有一些前瞻性队列研究显示,遗传性易栓症与胎盘早剥之间也没有关联(Dizon-Townson, 2005; Silver, 2010)。相反,Alfirevic等(2002年)报道了V leiden杂合、纯合突变以及凝血酶原G20210A杂合突变与一些不良结局相关。
研究表明,遗传性易栓症与子痫前期相关性研究结论也存在矛盾(ACOG,2020a)。一项大型系统回顾和荟萃分析,对近22,000名妇女的研究没有显示出V leiden或凝血酶原突变与子痫前期的关系(Rodger,2010)。同样,最近的一项前瞻性研究没有显示出子痫前期和12种遗传性易栓症之间有关联(FernandezArias,2019)。
因此,由于风险和获益的不确定性,不建议对遗传性易栓症普遍筛查和预防(Louis-Jacques,2016)。相比之下,APS与不良妊娠结局(包括胎儿丢失、复发妊娠丢失和子痫前期)之间的相关性要强得多(Liu,2019年)。
鉴于人群中易栓症相对较高,但VTE发病率很低,在妊娠期间进行普遍筛查并不具有成本效益。因此,需要采取选择性的筛查策略。ACOG(2020a)建议在以下临床情况下,应考虑易栓症筛查(1)个人VTE病史,伴或不伴复发风险如骨折、手术或长期制动等因素;以及(2)有高危遗传性易栓症的一级亲属(父母或兄弟姐妹)。如前所述,对复发性胎儿丢失或不良妊娠结局妇女,不推荐筛查遗传性易栓症。
筛查较常见的遗传性血栓性疾病的方法如表1所示。实验室检查尽可能在发生血栓事件后至少6周,应在非孕期、且没有接受抗凝或激素治疗时检测。最后,也不建议对高半胱氨酸血症进行筛查(ACOG,2020a)。
表1 易栓症检测
|
|
|
|
|
|
|
|
|
是
是
|
是
是
|
否
是
|
|
|
|
是
|
是
|
是
|
|
|
|
是
|
否
|
否
|
|
|
|
否a
|
否
|
否
|
|
|
|
是
|
否
|
否
|
a如妊娠期必须检测,游离蛋白S水平在中、晚孕期的截止值分别为<30%和<24%。