一、定义
弥散性血管内凝血(DIC)是临床常见的病理生理过程,可由感染、肿瘤、创伤、中毒、病理产科、肝病、血管病、热射病和自身免疫性疾病等多种疾病引起。经典DIC通常是指在上述致病因素作用下,凝血因子和血小板被激活,大量促凝物质入血,使凝血酶增加,进而微循环中形成广泛的微血栓,大量微血栓形成消耗了大量凝血因子和血小板,同时继发纤维蛋白溶解功能增强,导致患者出现明显的出血、休克、多器官功能障碍和溶血性贫血等临床表现的综合征。由于DIC致病因素的不同,其所对应DIC病理生理过程和临床特点也各有不同,故此增加了临床诊断的难度,现行的诊断标准也很难对各种病因的DIC都做到精确诊断。
二、概念演变
1928年,美国GregoryShwartzman博士发现将少量的脑膜炎双球菌培养滤液注射到家兔皮下,经过8-24小时后,再将少量的同一滤液注射到静脉中时,4-8小时左右在皮内注射部位可引起出血和坏死等强烈的皮肤反应, 这一现象被命名为局部Shwartzman现象。其后发现第一次通过静脉注入多种小剂量细菌培养液,经过8-24小时后第二次静脉注入内毒素,家兔除了出现局部皮肤损害外,还会出现血压下降甚至休克、双侧肾上腺皮质坏死、急性出血坏死性胰腺炎、 暴发性紫癜、血小板与粒细胞减少症等多器官损害,这种现象被命名为全身Shwartzman现象。1951年,Schneider提出胎盘早剥的患者会出现纤维蛋白栓塞,并将这一疾病正式命名为DIC。1955年,Stetson提出Shwartzman现象普遍存在凝血系统的显著改变,其机理主要与内毒素有关。同年,Crowell报道复苏后的急性循环衰竭也会出现严重凝血紊乱;Ratnoff报道妊娠期相关疾病如胎盘早剥、羊水栓塞、宫内死胎、先兆子痫等均可引起DIC;1956年Hardaway 报道不同类型的输血会导致血管内凝血。1958年,美国陆军医院的Robert M报道用羊水静脉注射和异型血输注的方法成功复制狗的DIC模型,结果显示,DIC模型组肝、肺和肾的微动脉、微静脉和毛细血管均广泛形成血栓,并伴有血压下降,应用肝素治疗可减轻血栓负荷。1964年,凝血瀑布学说的提出让DIC研究者认识到DIC并不仅仅是血栓弥散形成的现象,而是一个涉及凝血与纤溶系统紊乱的多器官损害的综合征。1969年,DONALDG. MCKAY博士发表了题为《DIC研究进展》的综述,明确提出DIC的形成涉及血小板聚集、凝血因子Ⅴ、Ⅶ、Ⅷ、Ⅸ、Ⅹ的活化、纤维蛋白血栓形成、纤溶系统活化和纤维蛋白被分解成纤维蛋白单体一系列病理生理过程。DONALD同时也认为DIC的诊断应该综合临床表现、病理检查、止血机制检测和肝素治疗试验。当时的DIC概念已经对DIC的病理生理过程有了较为全面的认识,但是临床诊断要求微血栓形成的证据和出血倾向的临床表现,而临床实践中很难直接明确诊断微血栓,这为DIC的诊断造成很大困难。2001年国际血栓止血学会(ISTH)将DIC定义为不同病因导致局部损害而出现以血管内凝血为特征的一种继发性综合征, 它既可由微血管体系受损而致, 又可导致微血管体系损伤,严重损伤可导致多器官功能衰竭。这一定义强调了微血管体系在DIC发生中的地位,指出DIC作为各危重疾病的中间环节,终末损害是多器官功能衰竭。
三、临床表现
DIC早期高凝状态期,可能无临床症状或轻微症状,也可表现血栓栓塞、休克;消耗性低凝期以广泛多部位出血为主要临床表现;继发性纤溶亢进期:出血更加广泛且严重,难以控制的内脏出血;脏器衰竭期可表现肝肾功能衰竭,呼吸循环衰竭是导致患者死亡的常见原因。
DIC典型的临床表现如下:
出血:自发性、多部位(皮肤、黏膜、伤口及穿刺部位)出血,严重者可危及生命。
休克或微循环衰竭:休克不能用原发病解释,顽固不易纠正,早期即出现肾、肺、脑等器官功能不全。
微血管栓塞:累及浅层皮肤、消化道黏膜微血管,根据受累器官差异可表现为:顽固性休克、呼吸衰竭、意识障碍、颅内高压、多器官功能衰竭。
微血管病性溶血:较少发生,表现为进行性贫血、贫血程度与出血量不成比例,偶见皮肤、巩膜黄染。
四、实验室检查
DIC的实验室检查包括两方面:
一是反映凝血因子消耗的证据,包括凝血酶原时间(PT)、部分激活的凝血活酶时间(APTT)、纤维蛋白原浓度及血小板计数;
二是反映纤溶系统活化的证据,包括纤维蛋白原/纤维蛋白降解产物(FDP)、D-二聚体、血浆鱼精蛋白副凝固试验(3P试验)。
此外,国外近年来开展分子标志物用于DIC早期诊断,发现部分标志物,如TAT可有诊断意义,有望用于临床。
五、分类
根据DIC的常见病因构成比,可将DIC分为脓毒症性DIC,肿瘤性DIC,创伤性DIC ,产科DIC和其他疾病导致的DIC。其他疾病导致的DIC又包括中毒性DIC、热射病性DIC、医源性DIC、放射性DIC、遗传性DIC和血管瘤性DIC等。
六、分型
1. 按代偿能力分型
DIC的发展是凝血与抗凝系统平衡的破坏,一方面是凝血因子和血小板的持续消耗,一方面是肝脏合成凝血因子和骨髓产生血小板补充消耗。根据凝血因子和血小板的代偿状况可将DIC分为代偿型(非显性)与失代偿型(显性)。这种分类方法便于临床区别DIC的严重程度,也是2001年ISTH国际DIC诊断标准推荐的分类法。
代偿型:特点是血小板和凝血因子的生成与消耗之间基本保持平衡。其临床特点为存在原发疾病,但无明显出血或器官功能障碍。实验室检查PT和APTT基本正常,血小板升高或正常,纤维蛋白原可升高,纤维蛋白原或纤维蛋白的降解产物出现。
显性型:特点是存在潜在的疾病,外科或静脉穿刺的部位渗血,肺、肾上腺等器官大出血,同时有微血栓诱发的器官缺血甚至多器官功能衰竭。实验室特点为PT+APTT延长,纤维蛋白原很低,血小板计数很低,并可测得纤维蛋白原或纤维蛋白的降解产物。
非显性型:特点是存在基础疾病,并因为微小血栓的形成导致早期器官功能损害。实验室检查可表现为PT+APTT正常或缩短,纤维蛋白原减少,血小板计数减少,纤维蛋白原或纤维蛋白的降解产物较明显。
以往还有学者提出过度代偿型DIC,认为经代偿凝血因子的生成多于消耗,主要见于慢性DIC或DIC恢复期,患者临床症状不明显。
2. 按发生时间分型
急性型:当DIC在数小时或1~2d内发病时,可称为急性型DIC。此时DIC致病因素较强,临床症状显著,常表现为显著的休克和出血,病情进展迅速,实验室检查明显异常。急性型DIC最常见于重症感染,革兰氏阴性菌引起的感染性休克发生率最高,病毒感染引起的急性型DIC预后最差,往往迅速发展到多器官功能衰竭。急性型DIC还见于严重创伤、大面积烧伤、异型输血、重症中暑、急性中毒、放射病、急性移植排斥反应等。
慢性型:因为机体存在一定的代偿能力,导致患者呈现慢性型DIC。此类型特点是病程长,临床表现不明显,常以某个器官功能异常为主要表现。慢性型DIC患者有时仅有实验室检查异常,直到最终尸检才能明确诊断。此类型常见于恶性肿瘤、胶原类疾病、慢性溶血性贫血、血管瘤、慢性中毒或低剂量辐射病等。
3. 按临床症状和病理机制分型
2014年4月,日本学者HideoWada在关于DIC诊断方法的论文中提出一种新的DIC分类法。这种新的分类方法按照DIC的临床症状和病理机制将DIC分为四种类型,即出血型(高纤型)、器官衰竭型(高凝低纤型)、大出血型(消耗型)和无症状型(前期)。
出血型(高纤型)-以纤溶亢进机制为主,临床主要表为出血,常见于创伤、白血病、产科疾病或主动脉瘤;
器官衰竭型(高凝低纤型)-以高凝低纤溶机制为主,临床主要表为微血栓导致的器官衰竭,常见于脓毒症;
大出血型(消耗型)-常见于严重外伤或产科疾病导致凝血因子严重消耗的患者;
无症状型(前期)-患者可仅有实验室检查异常而不表现临床症状。这种分类方法有机结合病因、病理机制和临床表现的分型,对临床治疗有一定的指导意义。
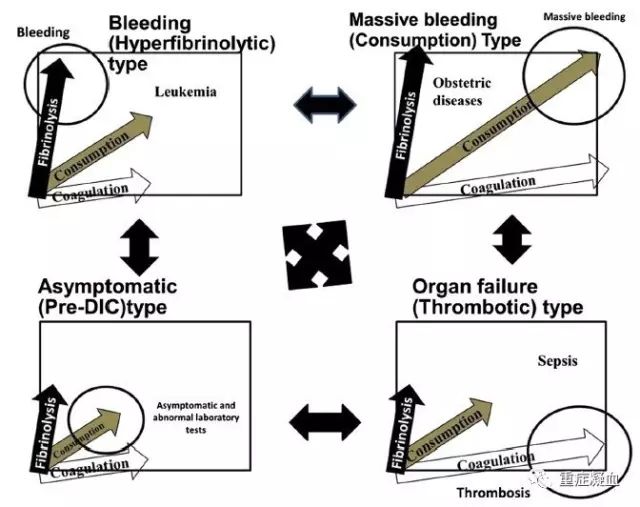
左上-出血型或高纤溶型;右上-大出血型或消耗型;左下-无症状型或前DIC型;右下-器官衰竭型或血栓型
如上图所示,DIC患者稳态的失衡可以从对高凝和纤溶亢进的向量和来判断。当纤溶亢进的向量显示优势,临床表现以出血为主要症状;这种类型从临床表现可称为出血型,从病理生理机制可称为高纤型;这种类型的DIC常见于白血病、产科疾病或主动脉瘤。当代表血液高凝状态的向量表现显著或呈现优势时,临床表现以广泛微血栓形成导致的多器官功能衰竭为主;这种类型的DIC从临床表现可称为器官衰竭型,从病理生理机制可称为高凝型DIC或高凝低纤型。这种类型的DIC以脓毒症为典型代表。细胞因子水平的显著升高会提高PAI-1的水平,从而导致低纤溶状态;血液中出现脂多糖(LPS)也是导致低纤溶的原因。此外,脓毒症患者会启动中性粒细胞胞外诱捕网(neutrophil extracellular traps,NET),NET能释放带有组蛋白的DNA、中性粒细胞弹性蛋白酶和组织蛋白酶G,这些物质都有捕获和杀死病原体的作用。组蛋白能促进血管内皮细胞凋亡和血小板聚集,中性粒细胞弹性蛋白酶和组织蛋白酶G能分解TFPI来促进血栓形成。此外,损伤、坏死的细胞会释放高迁移率族蛋白1(HMGB1)增强炎症反应。
当患者的高纤溶向量和高凝血向量都很显著而且强烈时,机体会发生大出血,如果没有充分的输血替代治疗,患者有可能迅速死亡。这种类型的DIC从临床表现上成为大出血型DIC,从病理机制上称为消耗性DIC。这种类型的DIC主要常见于严重外伤或产科疾病导致凝血因子严重消耗的患者。最后,当纤溶和凝血的向量作用都不强烈并基本相当时,患者可仅有实验室检查异常而不表现临床症状,这种类型的DIC即称为无症状型DIC或前期DIC。在一项回顾性研究中,前期DIC的治疗见效明显,这四种类型DIC的诊断和治疗均明显不同。
七、分期
根据DIC的病理生理发展过程,可分为如下三期:
1.高凝期
各种病因导致凝血系统激活后,凝血酶产生增多,促进纤维蛋白原形成纤维蛋白,微循环中大量微血栓形成,血液表现为高凝状态。此期为发病之初,部分患者可无症状,急性DIC时高凝期时间短,不易发现。实验室检查特点为凝血时间缩短,血小板黏附性增加。
2.消耗性低凝期
凝血酶产生和微血栓形成后,血小板和凝血因子大量消耗;同时继发性纤溶系统激活,血液表现为低凝状态。此期患者已有严重程度不等的出血症状,部分患者出现休克或脏器功能衰竭。实验室检查特点为血小板明显减少,血浆纤维蛋白原含量明显减少,凝血时间延长,也可有纤溶相关指标异常。
3.继发性纤溶亢进期
凝血酶及因子Ⅻ活化后激活纤溶系统,形成大量纤溶酶,进而形成FDP,增强纤溶和抗凝作用,本期患者可表现为难以控制的出血,并伴有休克和MODS的临床表现。实验室检查特点为凝血酶时间(TT)延长,血浆鱼精蛋白副凝固试验(plasmaprotamine paracoagulation test, 简称3P试验)阳性,凝血块溶解时间缩短。
八、诊断
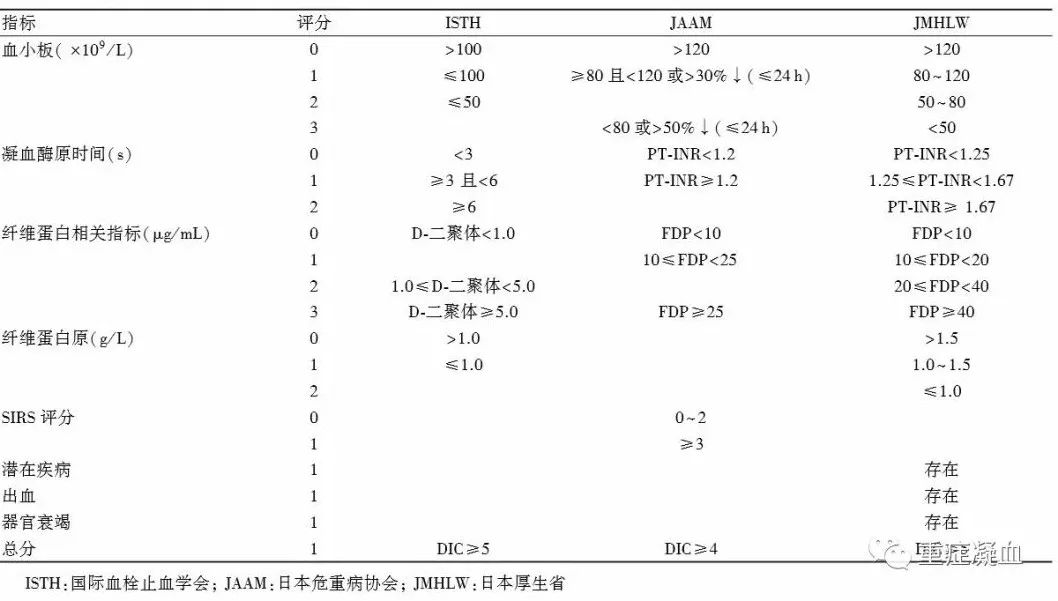
1987年日本厚生省(JMHLW)颁布第一个DIC诊断积分系统(见表1)。该系统主要纳入临床症状、凝血酶原时间(PT)比率、PLT计数、纤维蛋白降解产物(FDP)和纤维蛋白原这些临床较普及的指标,根据不同程度的积分值来诊断DIC,评分≥7分即可诊断DIC,使DIC的临床诊断简便可行。JMHLW标准从典型DIC的凝血与纤溶系统的稳态破坏的角度对DIC进行诊断,是对DIC诊断的巨大贡献。该诊断标准提出时并未对DIC做出定义,是该评分系统的不足。
2001年,ISTH的科学标准委员会(SSC)正式颁布了目前国际上使用最广泛的诊断标准。这个DIC诊断积分系统主要采用PT、PLT、纤维蛋白原(fibrinogen,Fig)和D-二聚体等指标进行积分,积分≥5即可诊断为显性DIC,<5分为非显性DIC,需要继续每日评估。相对于JMHW标准,ISTH标准去除了临床症状体征,强调了DIC基础疾病的重要性。ISTH诊断标准发布时同时确定了DIC的定义,提出了显性DIC与非显性DIC的概念,并强调凝血紊乱的动态观察。ISTH诊断标准还强调了凝血系统分子标志物的重要性,其在非显性DIC诊断标准中提出了可溶性纤维蛋白单体(sFMC)、抗凝血酶(AT)、蛋白C(PC)、凝血酶-抗凝血酶复合物(TAT)、纤维蛋白凝血酶原片段F1+2、纤溶酶-抗纤溶酶复合物(PAP)等,但是ISTH诊断标准并未给出分子标志物的具体变化范围。同样在显性DIC标准中,针对D二聚体等纤溶指标也没有明确给出中度升高和重度升高的具体标准。根据多数文献研究的规范,通常把D二聚体升高到正常值范围的2-10倍定义为中度升高,5倍以上定义为重度升高。有学者对JMHW和ISTH显性DIC诊断标准进行比较研究,结果显示两者的诊断一致率为67.4%,特别是对白血病患者两者诊断一致率较高。ISTH显性DIC诊断标准与JMHW 标准相比特异性较高,但是敏感度低,提示ISTH显性DIC标准对诊断典型DIC效果显著,但很难诊断出早期阶段的DIC。
2005年,日本危重病协会(JAAM)再次提出新的DIC诊断标准-JAAM诊断标准。出于对脓毒症的重视,JAAM诊断标准专门纳入SIRS评分,并且将血小板计数变化比率纳入积分,结合常规凝血项目评分,≥4分即可诊断DIC。JAAM标准更加关注DIC的炎凝交互作用,取消了纤维蛋白原这一低敏感、高特异的指标,增加了严重损伤的积分比重,提高了JAAM标准对炎症反应尤其是脓毒症相关凝血异常的敏感度。这三种DIC诊断标准对患者死亡率的敏感度和特异度各不相同,一般来说,JAAM标准的28d死亡率敏感度最高(80%,p<0.001),而ISTH显性DIC标准的特异度最高(71.4%,p<0.001)。近年来随着研究的不断深入,发现 SIRS评分对预后的判断价值不大。2016年,脓毒症的定义进行了第三版更新,取消了SIRS的概念。因此,同年JAAM就对DIC诊断标准进行了修订。修订后JAAM诊断标准更偏重脓毒症,以AT3作为评价指标取代SIRS评分,以AT3活性≤70%积1分,>70%不积分评价DIC。研究结果显示,新版JAAM诊断标准对DIC患者的死亡率判断与原JAAM诊断标准类似,其益处在于引入AT3指标可能对脓毒症患者启动抗凝治疗的时机更加敏感。
表1-三种DIC诊断标准
此外,韩国血栓与止血学会(KSTH)在2007年也颁布DIC的诊断标准,该标准主要纳入血小板计数、PT、APTT、纤维蛋白原和D二聚体,总分采用3分制。有研究报道在131例患者中评价DIC患者,KSTH标准与ISTH相比诊断符合率为85%。2012年意大利血栓与止血学会颁布的《DIC诊断与治疗指南》中对于可疑DIC患者,建议应用ISTH、JMWH、JAAM评分,但不建议使用KSTH标准。
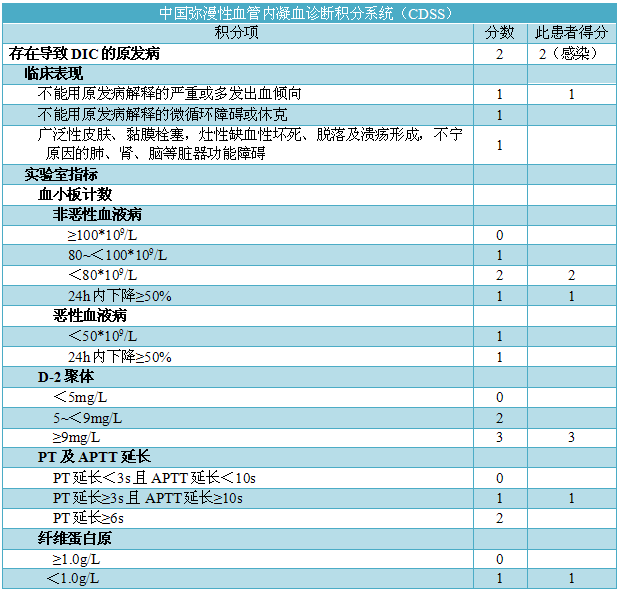
上述积分系统目前在国内临床使用较为混乱,尚无在中国人群对上述三大积分系统进行验证的研究数据。为进一步推进中国DIC诊断的科学化、规范化,统一诊断标准,中华医学会血液学分会血栓与止血学组于2014年起通过多中心、大样本的回顾性与前瞻性研究,建立了中国弥散性血管内凝血诊断积分系统(Chinese DIC scoring system,CDSS)(表2),该系统突出了基础疾病和临床表现的重要性,强化动态监测原则,简单易行,易于推广,使得有关DIC诊断标准更加符合我国国情。此外,DIC是一个动态的病理过程,检测结果只反映这一过程的某一瞬间,利用该积分系统动态评分将更有利于DIC的诊断。
表2-中国弥散性血管内凝血诊断积分系统(CDSS)
DIC亚型的诊断标准
脓毒症引起的DIC是经典DIC的病理生理过程,可分为经典的高凝期、消耗性低凝期、继发性纤溶亢进期,主要机制包括促凝机制上调、生理性抗凝机制受损和纤溶抑制。2014年,日本学者Hiroyasu Ishikura等提出应用JAAM DIC诊断标准联合脓毒症诊断标准制定新的脓毒症性DIC诊断标准。
研究筛选出两个新的脓毒症性DIC分子标志物Presepsin和PC。Presepsin是是CD14 的N 端片段,亦称可溶性 CD14 亚型(sCD14-ST)。符合JAAM-DIC诊断标准的患者根据Presepsin和PC可分为三层:
重度, presepsin>900pg/mL且PC<45%;
轻度, presepsin<650pg/mL且PC>45%,或650 < presepsin<900pg/mL并PC>55%
中度,即处于轻重度之间
该诊断标准对脓毒症性DIC诊断的灵敏度和特异度依次为 80.7%和87.5%,轻中重度分级的死亡率依次为 7.14%, 15.4%,和28.6%。这样的诊断标准因为新型分子标记物在临床检验中的限制,很难在实际工作中应用。在脓毒症3.0定义颁布后,日本学者Iba T也相应提出新的脓毒症性凝血病的诊断标准。标准纳入PT比率、血小板计数和序贯器官衰竭(SOFA)评分三项指标,评分≥4分或前两项凝血相关积分之和>2分即可诊断(见表3)。该标准对死亡率预测价值优于JAAM-DIC诊断标准(38.4%vs34.7%)。
表3-脓毒症性凝血病评分系统

创伤大出血引发的凝血障碍也是近年来研究的热点问题,对于创伤时的凝血障碍是创伤性凝血病还是DIC的一种亚型还有不少争议。1975年,B. Schiefer等就提出了消耗性凝血病的概念,并阐述了DIC和消耗性凝血病的病理生理机制的区别,即DIC以广泛的血管内纤维素沉积为特征,而后者以凝血因子消耗造成出血为特征。后续临床研究中也出现了急性创伤性凝血病(ATC)、创伤性凝血障碍(TIC)、创伤早期的凝血病等诸多名词。2008年,美国学者John R. Hess在创伤杂志)提出了“急性创伤休克性凝血病”(ACoTS)的概念,并强调ACoTS的主要发病机制包括组织损伤、休克、血液稀释、低体温、酸中毒和炎症反应这六个方面,并强调ACoTS与DIC应作为两种疾病来处理。日本学者Gando则认为创伤性凝血病本质上是DIC的纤溶型,在急诊创伤患者接受急诊医疗干预之前就已出现,创伤、外科手术、感染和缺血再灌注损伤所带来的炎症、神经内分泌异常、凝血和纤溶失衡都只是机体的非特异反应,血液稀释和低体温仅是开始救治创伤后才出现的会影响DIC发展的因素。因此,ACoTS的概念并不具备独立提出的条件,反而不如应用DIC纤溶型(或出血型)更适合。临床诊断方面,创伤性凝血病目前常采用的诊断标准为:在明确创伤病史的前提下,APTT>35S和/或INR>1.2。这个诊断标准相对于DIC评分法比较宽松。2014年,学者Akiko Oshiro应用DIC评分法分析了562名创伤性凝血病患者,结果发现创伤早期DIC患者的高FDP、D-二聚体水平和高FDP/D-二聚体比率可以判定纤溶型DIC。纤溶型DIC会持续展现为低水平的PLT计数、纤维蛋白原水平和抗凝血酶活性,以及较高的INR、FDP和D-二聚体水平。血栓弹力图(TEG)在评价创伤患者凝血功能障碍及指导成分血输注方面具有显著临床价值,对凝血异常的灵敏度高于普通凝血检查项目。笔者对应用TEG诊断128例创伤患者进行回顾性研究,结果显示采用TEG评分总分≥2分作为TEG⁃DIC诊断标准,诊断DIC的发病率要高于ISTH—DIC诊断标准(TEG积分项目:R>582s=1;K>394s=1;Angle< 39°=1;MA<39.5mm=1)。
九、鉴别诊断
血栓性血小板减少性紫癜(TTP)
TTP是一组以血小板血栓为主的微血管血栓出血综合征,其主要临床特征包括微血管病性溶血性贫血、血小板减少、神经精神症状、发热和肾脏受累等。遗传性TTP系ADAMTS13基因突变导致酶活性降低或缺乏所致;特发性TTP因患者体内存在抗ADAMTS13自身抗体(抑制物)而导致ADAMTS13活性降低或缺乏;继发性TTP由感染、药物、肿瘤、自身免疫性疾病等因素引发。
溶血性尿毒症综合征(HUS)
HUS是以微血管内溶血性贫血、血小板减少和急性肾功能衰竭为特征的综合征。病变主要局限于肾脏,主要病理改变为肾脏毛细血管内微血栓形成,少尿、无尿等尿毒症表现更为突出,多见于儿童与婴儿,发热与神经系统症状少见。HUS分为流行性(多数有血性腹泻的前驱症状)、散发性(常无腹泻)和继发性。实验室检查:尿中大量蛋白、红细胞、白细胞、管型、血红蛋白尿、含铁血黄素及尿胆素,肾功能损害严重;HUS患者血小板计数一般正常,血涂片破碎红细胞较少,血浆ADAMTS13活性无降低。
原发性纤溶亢进
严重肝病、恶性肿瘤、感染、中暑、冻伤可引起纤溶酶原激活物抑制物(PAI)活性减低,导致纤溶活性亢进、纤维蛋白原减少、其降解产物FDP明显增加,引起临床广泛、严重出血,但无血栓栓塞和微循环衰竭表现。原发性纤溶亢进时无血管内凝血存在,无血小板消耗与激活,因此,血小板计数正常。由于不是继发性纤溶亢进,故D-二聚体正常或轻度增高。
严重肝病
多有肝病病史,黄疸、肝功能损害症状较为突出,血小板减少程度较轻、较少,凝血因子Ⅷ活性(FⅧ∶C)正常或升高,纤溶亢进与微血管病性溶血表现少见,但需注意严重肝病合并DIC的情况。
原发性抗磷脂综合征(APS)
临床表现包括:血栓形成,习惯性流产,神经症状(脑卒中发作、癫痫、偏头痛、舞蹈症),肺高压症,皮肤表现(网状皮斑、下肢溃疡、皮肤坏死、肢端坏疽)等;实验室检查:抗磷脂抗体抗体(APA)阳性,抗心磷脂抗体(ACA)阳性,狼疮抗凝物质(LA)阳性,BFP-STS相关抗体假阳性,Coomb试验阳性,血小板数减少及凝血时间延长。
十、治疗
替代支持治疗
十一、预后
来源-夜诊综合整理自重症凝血-宋景春编写;弥散性血管内凝血诊断中国专家共识(2017年版);弥散性血管内凝血诊治进展(中国实用内科杂志)

