弥散性血管内凝血(DIC)是继发于多数危重症的复杂外周循环系统的病理改变,涵盖了凝血系统的激活、血小板活化以及纤维蛋白的沉积,大量凝血因子的消耗以及纤溶系统的亢进。
临床上的突出表现:出血、栓塞、微循环障碍、微血管病性溶血。这些表现出现时间短、病情复杂、发展迅速、诊断难以准确、死亡率高。
在考虑DIC前,需要充分考虑背景疾病,即可能的危重症发生基础,包括感染、实体肿瘤、恶性血液病、创伤、手术以及产科并发症。
查体应留意患者基本生命体征,心率如过快120bpm以上、呼吸频率高、血压进行性下降、在标准吸氧条件下氧饱和仍然勉强维持在95%以下时,需警惕。而进一步检查面色,如意识较差、面色苍白、口唇紫绀、四肢湿冷、皮肤多瘀斑时,需要考虑DIC可能。再进一步检查手术切口有无渗血,或消化道出现大量出血可能。综合以上证据,可基本考虑DIC已经出现。
急查的检验结果需进一步着重对凝血功能的判断:APTT 如延长20S以上、PT延长8S以上、凝血酶时间TT延长5S以上、纤维蛋白降解产物FDP上升达100ug以上、3P试验++,D二聚体>1mg,而肝肾功能尚无明显异常,可基本证实DIC。
治疗方案:,1. 需紧急予以高流量面罩吸氧;2.地塞米松20mg ivgtt抗过敏;3.肝素5000U初始静滴,随后2500U q8h静滴;4.连续输注血小板悬液、新鲜冰冻血浆、冷沉淀、纤维蛋白原、红细胞等;
当予以以上治疗后,可基本数小时后控制病情不至于进一步恶化。凝血功能需要每4-6小时复查一下。可出现肾脏血流减少导致的尿少以及进行性肌酐升高和尿素氮升高。此时需要多巴胺予以维持肾脏血流灌注。
在此基础上,持续治疗3天,基本可见原临床表现基本控制。
但是DICD的治疗多需考虑分期原则,
早期DIC需要尽早识别,在如下症状出现时需对DIC纳入鉴别诊断:广泛性皮肤黏膜缺血性坏死、栓塞、脱落以及溃疡;呼吸浅快+低氧血症;肾及其他脏器的功能异常衰竭;休克无法控制;PT或APTT正常或缩短;血小板计数以及纤维蛋白原不低;但是目前凝血功能的改变尚不足以预判DIC。在DIC早期予以抗凝治疗为主(5000U肝素首次,2500U q8h,连续3-5天;通过APTT评估普通肝素使用,以APTT延长为对照组1.5-2倍适宜;如使用低分子肝素,需要50U/kg/d,q12h,疗程5-8天,无需严格凝血监测),一旦怀疑就需要积极干预DIC,不应该被动等待检查结果确诊DIC。
中期DIC,为消耗凝血因子,出现PT及APTT显著延长,血小板及纤维蛋白原进行性下降,FDP及D二聚体可轻度升高。此时治疗为充分抗凝+输注新鲜冰冻血浆及冷沉淀等。一般急诊入院病人多已到达中期,需要同时予以抗凝肝素+凝血因子补充和抗休克等综合治疗。
晚期DIC,为继发性纤溶亢进,因此临床以出血为主,FDP及D二聚体显著升高为最显著特征。如纤溶亢进为主要矛盾,需要适量予以抗纤溶药,但是抗纤溶治疗需要重视使用条件,否则适得其反。
这里总结一下肝素使用的原则:1.DIC早期;2.明显多发栓塞现象,包括急性肾功能及呼吸功能衰竭等;3.顽固性休克伴其他循环衰竭且常规抗休克效果不佳。但是DIC晚期或活动性出血均不能使用肝素。
回到诱发DIC的病因治疗上,控制DIC的最根本措施是控制原发病。因此,当病因为感染时,需要采用广谱早期足量的抗生素治疗。而休克、酸中毒等导致的DIC,需要积极予以支持治疗消除不良影响。另外需要排除既往免疫性血小板减少症、再生障碍性贫血、原发性凝血功能障碍等。
实例分析:
一例男性60岁肿瘤晚期患者,凝血功能如下:
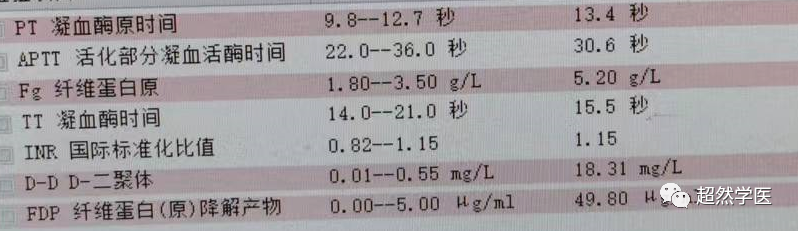
根据DIC的凝血功能判断标准:
| 评分 |
|
| 纤维蛋白原>=1g |
0 |
| 纤维蛋白原<1g |
1 |
| PT延长<3s APTT延长<10s |
0 |
| PT延长>=3s APTT延长>=10s | 1 |
| PT延长>=6s |
2 |
| D二聚体<5mg |
1 |
|
D二聚体 5mg-9mg |
2 |
| D二聚体 >=9mg | 3 |
| PLT >=100*10^9 |
0 |
| PLT 80-100 | 1 |
| PLT<80*10^9 | 2 |
| 24小时内下降>=50% | 1 |
非恶性血液病患者总得分>=7,诊断为DIC。
该患者为3分,因此暂不考虑DIC。
因此,综合以上及体检等结果综合判断,患者目前尚不属于DIC。
但是对于此患者,需要明确的诊断包括如下:
-
原发性纤溶亢进
-
严重肝病
-
溶血性尿毒症综合征
-
原发性抗磷脂综合征
-
血栓性血小板减少性紫癜

