急性早幼粒细胞白血病占急性髓性白血病的19%,其三大特征中包含了出血。APL出血表现包括皮肤和黏膜出血、咯血、血尿、阴道出血、消化道出血、肺和颅内出血。严重广泛的出血,特别是颅内出血是导致患者早期死亡的重要原因。引发出血的病理机制主要是DIC和纤溶亢进。
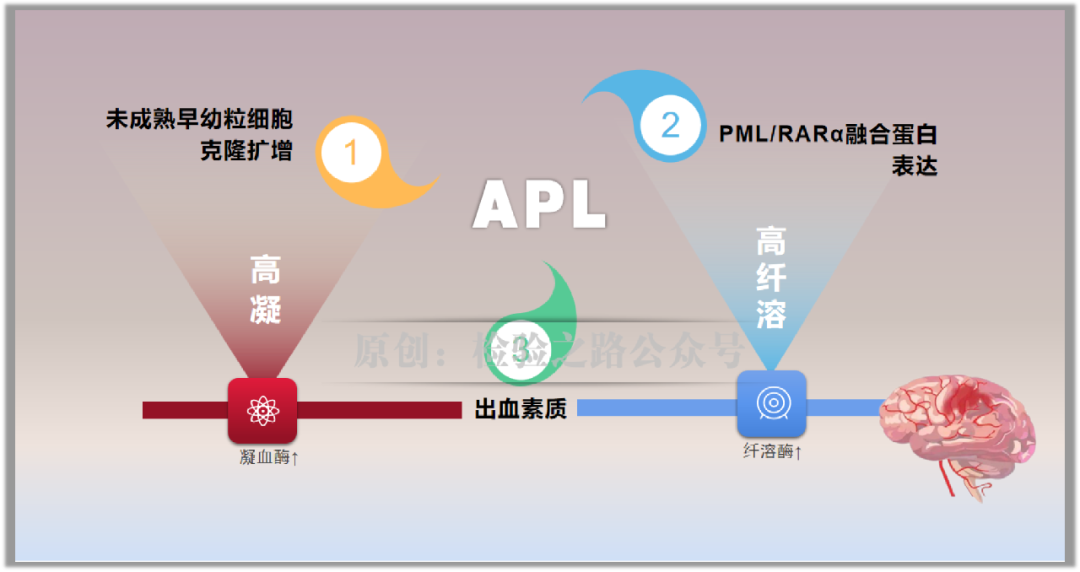
图1.原创图片,引用请注明出处。
纤溶系统的调控
 纤溶酶原,奔赴何方
纤溶酶原,奔赴何方
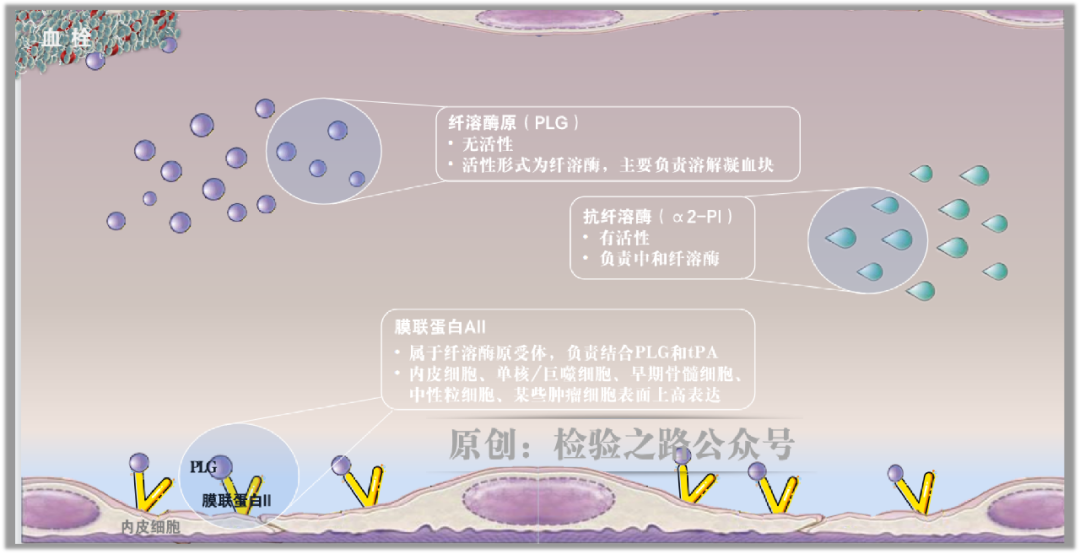 图2.原创图片,引用请注明出处。
图2.原创图片,引用请注明出处。
如图2所示,在循环中存在着无活性的纤溶酶原(PLG)和时刻准备战斗的a2纤溶酶抑制剂(α2-AP),均由肝脏合成。
为便于理解和记忆,我喜欢把a2纤溶酶抑制剂称作‘抗纤溶酶’。
血管内皮细胞表面有一种纤溶酶原受体——膜联蛋白AII,专门结合循环中的PLG(PLG的赖氨酸结合位点,可结合膜联蛋白AII的赖氨酸残基)。
血凝块中的纤维蛋白也能高亲和力结合PLG(PLG的赖氨酸结合位点,可结合纤维蛋白的赖氨酸残基)。
-
为什么机体要在内皮细胞表面布局’膜联蛋白AII‘?
-
为什么要让PLG高效结合到‘膜联蛋白AII‘上?
-
为什么要让PLG高效结合到血凝块上?
 纤溶酶的受控活化
纤溶酶的受控活化
当局部血管内皮细胞受到刺激,内皮细胞合成并释放组织型纤溶酶原激活剂(tPA)(图3)。链接:凝血知多少‖纤溶点火器(1) t-PA
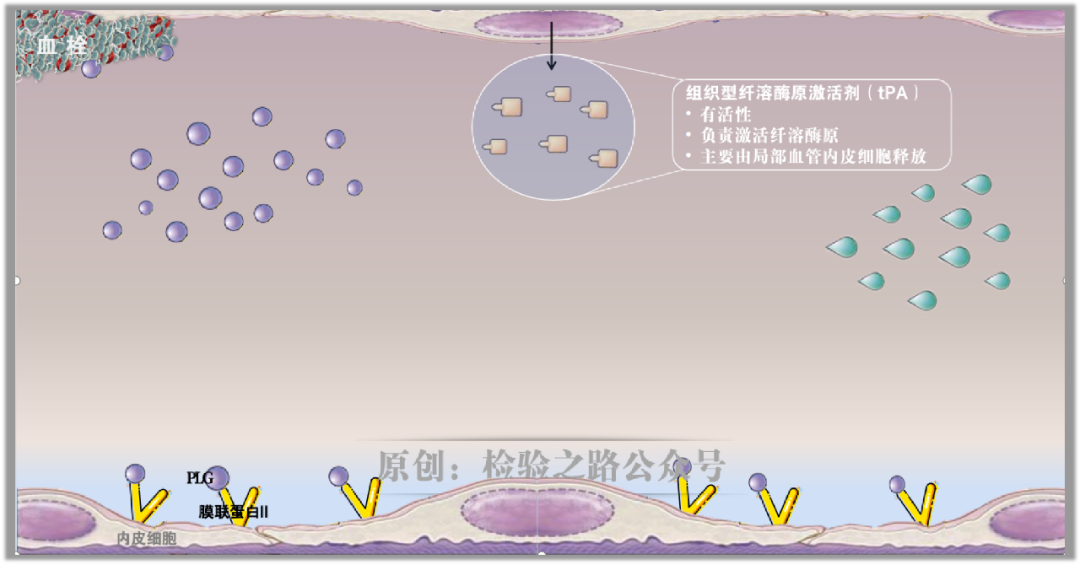 图3.原创图片,引用请注明出处。
图3.原创图片,引用请注明出处。血流中的tPA会高效结合到膜联蛋白AII、纤维蛋白凝块上,因为在膜联蛋白AII上有tPA的结合位点。瞧,战场明确!
tPA的任务就是激活PLG,使其变为具有活性的战士——纤溶酶。瞧,目标专一!
于是,无论是血循环中(全身性)、还是细胞表面或血凝块上(局部性),都能够发生纤溶酶的活化(图4)。
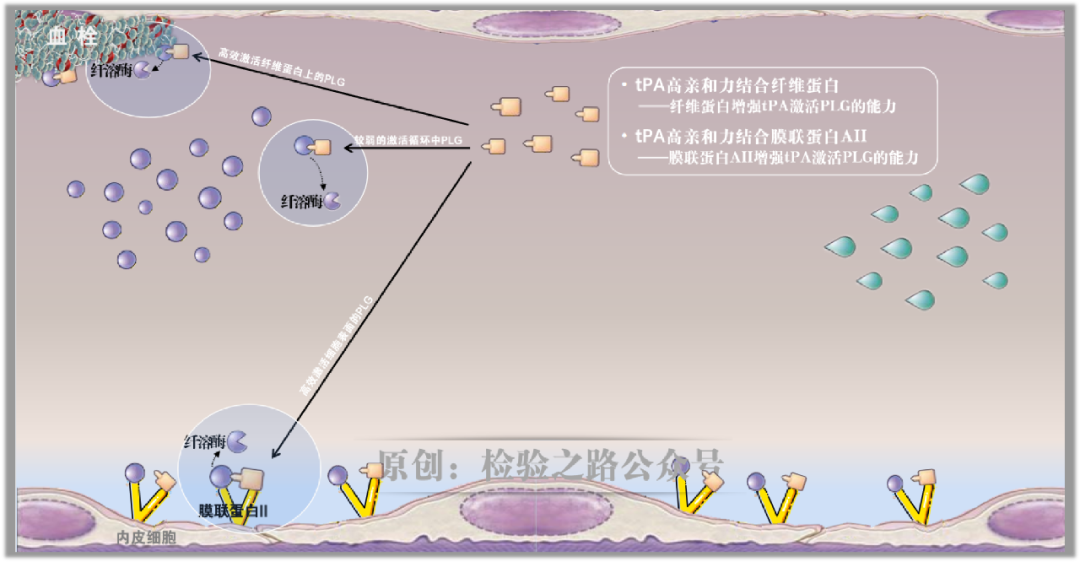 图4.原创图片,引用请注明出处。
图4.原创图片,引用请注明出处。纤溶酶如同清淤兵,主要任务就是溶解纤维蛋白。但纤溶酶不专一,还会水解循环中的多种蛋白,如FIB、Ⅴa、Ⅷa、vWF、补体等。你是不是意识到了,花心的纤溶酶太危险了!链接:凝血知识知多少‖纤溶酶为何会导致出血
别担心,机体考虑到了这一点!
生理情况下,循环中游离的纤溶酶会迅速被等候已久的α2-AP结合而失活,故不出现FIB等蛋白的降解。仅靠一个保险措施还不够安全,机体还安排内皮细胞受到刺激时不仅释放tPA,还能释放PAI-1,游离的tPA如果在5分钟内没有找到结合的目标,就会被PAI-1结合而失活。如此严格控制循环中纤溶酶活性的目的是防止其恶意破坏纤维蛋白原,因为纤维蛋白原如果被纤溶酶过早降解,势必导致止血凝块生成障碍,甚至引发出血。
而在内皮细胞表面和血凝块上,则是另一番景象。纤溶酶一旦结合在膜联蛋白AII和血凝块上,就获得了保护,能免受循环抑制物的中和。而从细胞表面和血凝块中释放到循环中的纤溶酶仍然会迅速被α2-PI灭活。
PLG和tPA在膜联蛋白AII、纤维蛋白上组装,膜联蛋白II和纤维蛋白均作为t-PA辅因子,不仅将纤溶酶生成效率提高,还能保护纤溶酶免受循环抑制物的中和。在内皮细胞表面、纤维蛋白沉积部位形成了一种局部而特殊的高纤溶活性环境。
为局部的纤溶活性提供安全避风港,目的之一就是,避免内皮表面纤维蛋白沉积,从而保证微血管畅通。
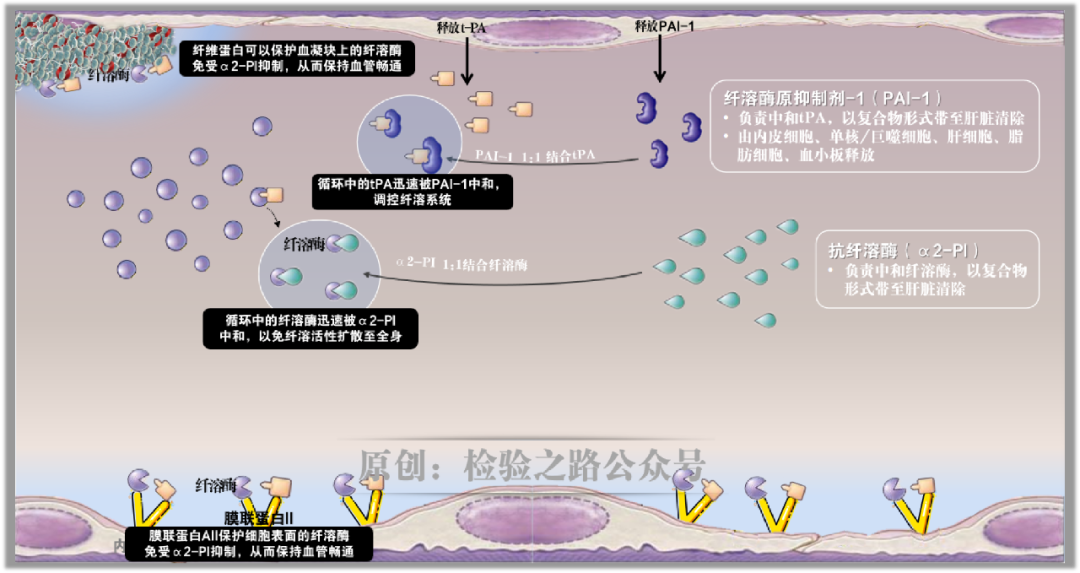
图5.原创图片,引用请注明出处。
【小结】
-
膜联蛋白AII作为纤溶酶原受体,介导纤溶装配,促进纤溶酶局部形成,在维持血管通畅中发挥重要作用
2. APL的纤溶活化
除了内皮细胞表面产生纤溶酶,在其他细胞上也可能产生纤溶酶,例如单核/巨噬细胞、早期骨髓细胞、中性粒细胞、某些肿瘤细胞表面上也高表达膜联蛋白AII。
在APL以外的白血病中,释放的纤溶酶仍能被α2-PI中和(图6)。
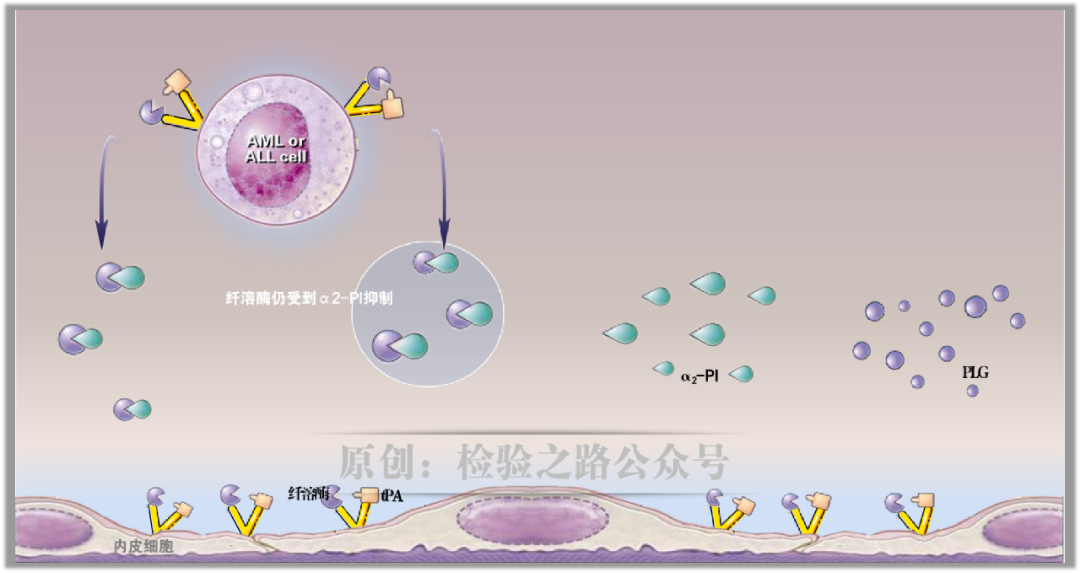
在APL中,由于膜联蛋白AII在白血病细胞上的过表达,纤溶酶以异常高的速率产生。结果,血浆中的PLG、α2-PI被大量消耗。随着α2-PI的快速消耗,失去了对抗纤溶酶的能力,导致有活性的纤溶酶在血浆中积累,如同失控的野马。最终,失控的纤溶酶导致纤维蛋白原↓、FV和FVIII ↓、血小板功能障碍,势必引发出血(图7)。
 图7.原创图片,引用请注明出处
图7.原创图片,引用请注明出处
瑞金医院王振义院士是世界上第一个用全反式维甲酸(ATRA)诱导分化疗法,治疗急性早幼粒细胞白血病并获得成功,让急性早幼粒细胞白血病,成为世界上第一个可被治愈的白血病。
ATRA是一种维生素A的类似物,主要通过诱导APL细胞分化成熟为中性粒细胞,起到治疗作用。此外还能够对APL患者的凝血功能障碍有一部分纠正作用。

【小结】
-
急性早幼粒细胞白血病中,APL细胞表面过表达膜联蛋白AII
-
膜联蛋白AII的过度表达所导致的纤溶酶过度生成,可能引发纤溶亢进性失血,特别是颅内出血,是APL患者早期死亡的重要原因。

