100%达临床终点!国产罕见病首创新药一次性通过国家双项关键核查
PNH是一种后天获得性溶血性疾病,是一种慢性、进行性、危及生命、罕见的多系统疾病,2018年被收录进《第一批罕见病目录》,目前尚无国产自研的靶向CFB抑制剂获批上市。
核查期间,药品监督管理局专家组秉持严谨专业的态度,围绕兰诺可泮的研制过程、商业化生产工艺、全生命周期质量管理体系、厂房设施与设备、质量控制实验室、制剂研发与生产现场、物料管理系统以及数据完整性管理等各个环节,开展了系统、深入的现场检查与文件审核。凭借覆盖药品全生命周期的立体化质量管理体系与高效的团队协同,启瑞集团本次以“零关键发现项”的卓越表现,一次性高标准通过核查。
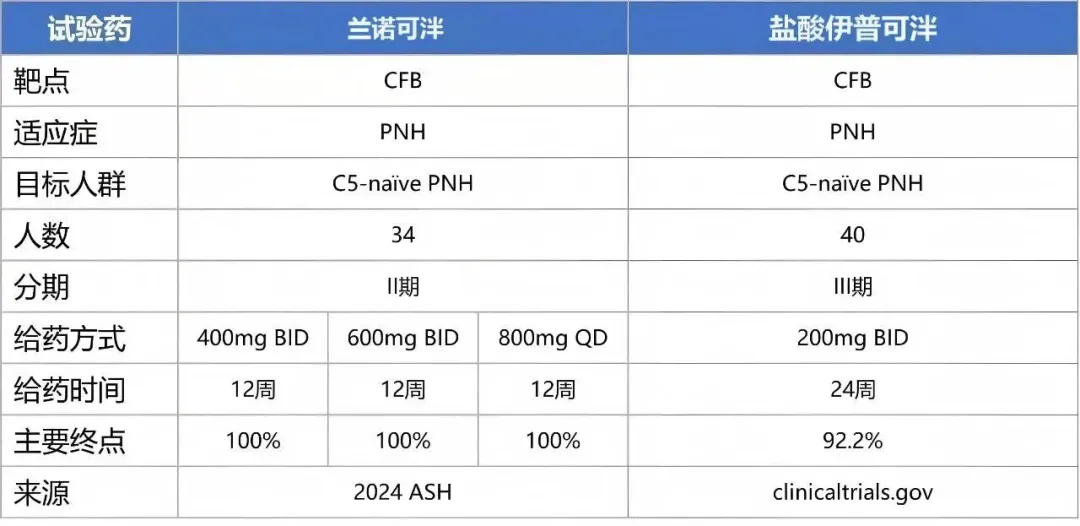
2024年,在美国血液学会(ASH)年会上,相关II期临床研究(NCT06050226)结果正式公布——这是一项针对未接受补体抑制剂治疗的PNH患者的多中心、开放标签、剂量探索研究,在无输血支持的情况下,第84天所有剂量组34例受试者(100%)均达到血红蛋白(Hb)浓度较基线增加≥20g/L的主要终点,且所有患者治疗后均无需输血。同年12月,该药品还获得美国食品药品监督管理局(FDA)孤儿药认定,用于治疗PNH。
扫码加入溶贫
及PNH病友群
申请好友时
请备注疾病类型
咨询和交流溶血性贫血(AIHA、PNH等)相关问题


