
对于许多癌症患者来说,传统治疗手段(如化疗、放疗)可能效果有限或伴随严重副作用。近年来,一种名为CAR-T细胞疗法的创新治疗技术,为血液恶性肿瘤患者带来了突破性希望。CAR-T究竟如何起效?适合哪些疾病?又有哪些风险和注意事项?本文将用最通俗的语言,为您揭开CAR-T疗法的神秘面纱。
——给免疫细胞装上“导航系统”
- “导航”识别癌细胞:癌细胞表面通常有特定抗原(如CD19、BCMA),CAR-T细胞通过人工设计的“导航系统”(CAR分子)锁定这些抗原,无需依赖人体复杂的免疫识别流程。
- 自主激活与增殖:传统T细胞需要多重信号才能激活,而CAR-T自带“一键启动”功能,可快速扩增并持续作战。
- 长效监控:部分CAR-T细胞会转化为记忆细胞,长期监控癌细胞复发。
一句话总结:CAR-T疗法是“取患者细胞→实验室升级→回输体内杀癌”的个性化治疗。
——四步流程,定制抗癌
- 采血提取T细胞:从患者血液中分离普通T细胞(类似献血)。
- 基因改造:在实验室中,用病毒载体将CAR基因导入T细胞,使其表达“导航系统”。
- 体外扩增:将改造后的CAR-T细胞大量培养至数亿甚至百亿级别。
- 回输患者体内:通过输液将CAR-T细胞送回患者体内,开启精准抗癌行动。
全程耗时约2-3周,需在专业医院严密监测下进行。
——血液肿瘤的“破局者”
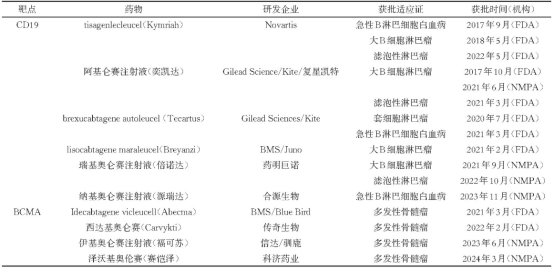
表1:截至24年4月已获批的
CAR-T细胞治疗药物
——从“无药可救”到长期生存
在复发/难治性B-ALL患者中,CAR-T的完全缓解率可达80%-90%,部分患者实现长期无病生存。针对多发性骨髓瘤,BCMA靶向CAR-T的客观缓解率约70%-90%。
持久性:
部分患者输注CAR-T后,体内CAR-T细胞可存活数年,形成“免疫记忆”,持续监控癌细胞复发。
个体差异明显:
疗效受患者年龄、肿瘤负荷、CAR-T细胞质量等因素影响。例如,肿瘤负荷过高或T细胞功能较差的患者可能效果不佳。
可控但需警惕
症状:高烧(>38.5℃)、低血压、呼吸困难(发生率约50%-90%)。
应对:托珠单抗(阻断IL-6)可快速控制,重症需ICU监护。
- 免疫效应细胞相关神经毒性综合征(ICANS)
症状:头痛、语言障碍、癫痫(发生率约20%-40%)。
提示:多与CAR-T细胞进入中枢神经有关,需及时使用激素治疗。
- 长期风险
继发肿瘤:极少数患者因基因编辑出现T细胞淋巴瘤(<0.1%)。
感染风险:治疗前需清除体内淋巴细胞,可能增加感染概率。
重要提示:上述副作用多在专业医院严密监测下可控,患者无需过度恐慌。
治疗前必读
选择正规医院:国家规定仅三级医院血液科或肿瘤中心可开展CAR-T治疗。
经济规划:
咨询医保政策(部分省市惠民保可报销30%-50%)。
关注药企援助项目(如复星凯特“患者援助计划”)。
副作用监测:治疗后1个月内需住院观察,出院后定期复查血常规、CAR-T细胞数量。
心理建设:疗效存在个体差异,需与医生保持沟通,理性看待复发可能。
参考文献:
[1]姚超,钱程.CAR-T细胞在肿瘤治疗中的机遇与挑战[J].中国肿瘤生物治疗杂志,2017,24(01):6-11.
[2]张凯杰,边诣聪,王燕,等.CAR-T细胞在血液恶性肿瘤治疗中的细胞动力学特征和研究进展[J].中国医院药学杂志,2025,45(03):337-342.DOI:10.13286/j.1001-5213.2025.03.15.
[3]廖彩凤,赖胡榕,李剑.血液肿瘤微环境对CAR-T免疫疗法疗效及其不良反应的影响的研究进展[J].中国实验血液学杂志,2024,32(04):1290-1294.DOI:10.19746/j.cnki.issn1009-2137.2024.04.048.

